Генетичні захворюванняЦеліакія (частина перша) Целіакія (інша назва глютенова ентеропатія) – це спадкове аутоімунне захворювання тонкої кишки, яке зустрічається у людей різного віку, навіть у дітей. Симптоми включають: хронічний пронос, затримку фізичного розвитку (у дітей), втому, проте можуть бути присутні й інші ознаки, які впливають на діяльність інших органів та систем. Все більша частка випадків целіакії діагностується ще до появи симптомів, в результаті застосування масового скринінгу. Як вважається, захворювання зустрічається в 1 особи з 1750-1105 в США. Целіакія виникає через негативну реакцію організму на гліадин - це проламін (білок клейковини (глютену)), який міститься у пшениці. Подібні білки виявлені також у рослинах, які відносяться до трибу пшеницевих (Triticeae tribe), який включає в себе інші зернові культури, такі як ячмінь і жито.

Під впливом гліадину, а саме трьох пептидів які були виявлені у проламінів, фермент тканинної трансглутамінази змінює білок, а імунна система вступає в перехресну реакцію з тканинами тонкої кишки, викликаючи запальні реакції, наслідком яких є пошкодження ворсинок тонкої кишки (так звана атрофія ворсинок). Це перешкоджає засвоєнню поживних речовин організмом, адже кишкові ворсинки є відповідальними за поглинання необхідних речовин. Єдиним відомим способом лікування є дотримання постійної безглютенової дієти. Варто зазначити, що хоча хвороба викликана реакцією на протеїни, які містяться в пшениці, проте це захворювання не можна назвати аналогічним алергії на пшеницю.
Для позначення цього розладу використовується декілька інших назв, у тому числі целіатична хвороба (cœliac з лігатурою œ), целіатичне спру (c(o)eliac, порушення всмоктування їжі), проте це нетропічне спру, а ендемічне, яке викликане глютеновою (клейковина) ентеропатією та непереносимістю клейковини. Термін целіакія походить від грецького κοιλιακός (koiliakόs, "черевний"), він був введений в обіг у 19 столітті, з огляду на переклади праць давньогрецького лікаря Аретея із Кападокії (Aretaeus of Cappadocia).
Ознаки і симптоми
Важка форма целіакії призводить до появи характерних симптомів: блідості, проносу і жирного стулу (стеаторея) і втрати ваги або нездатності набрати вагу (у маленьких дітей). Люди з середньою формою целіакії можуть мати ознаки, які більш приховані і зустрічаються в інших органах, а не в самому кишківнику. Крім того можливим є варіант безсимптомного перебігу хвороби. У багатьох дорослих з «витонченою» хворобою спостерігається тільки втома або анемія. Шлунково-кишкові ознаки
Діарея, яка характеризує целіакію є блідуватою, тривалою та супроводжується неприємним запахом. Крім того, характерними при хворобі є: - біль у животі і спазми; - здуття живота з підвищенням внутрішньочеревного тиску та об'єму (який, як вважається виникає у зв'язку з ферментативним утворенням кишкових газів);
- виразки ротової порожнини;
- оскільки прогресує ураження ворсинок тонкої кишки, то може розвиватись непереносимість лактози (гіполактазія).
Часто спочатку ці симптоми пов’язують із синдромом подразненого кишечника (СПК) і тільки пізніше визначають наявність целіакії. У незначного числа пацієнтів з симптомами СПК їх причиною є целіакія, проте скринінг для визначення целіакії рекомендується усім людям із симптомами СПК.
Целіакія призводить до підвищення ризику появи як аденокарциноми (раку тонкої кишки), так і лімфоми тонкої кишки (асоційована з ентеропатією Т-клітинна лімфома або АЕТЛ (англ. EATL)). Цей ризик зменшується за умови застосування відповідної дієти. У хворих на пізніх стадіях, без належного лікування з’являються інші ускладнення, такі як виразкове запалення тонкої кишки (утворення виразок у тонкої кишці) та її звуження внаслідок рубцювання через непрохідність тонкої кишки. Симптоми пов’язані з мальабсорбцією
Зміни у стінці тонкої кишки (атрофія ворсинок) зменшують її здатність всмоктувати поживні речовини, мінерали та жиророзчинні вітаміни A, D, Е та К. * Нездатність поглинати вуглеводи і жири може призвести до втрати ваги (або затримки росту у дітей), втоми або нестачі енергії. * Анемія може розвиватися в декількох напрямках: порушення всмоктування заліза при мальабсорбції може привести до залізодефіцитної анемії, а порушення всмоктування фолієвої кислоти і вітаміну В12 до мегалобластної гіперхромної (вітамінодефіцитної) анемії. * Мальабсорбція кальцію і вітаміну D (і відповідно вторинного гіперпаратиреозу) може призвести до остеопенії (зниження мінеральної щільності кісток) або остеопорозу (крихкість кісток та підвищений ризик їх переломів внаслідок зменшення їх маси ). * Невелика частка пацієнтів має аномальну коагуляцію у зв'язку з дефіцитом вітаміну К і мають підвищений ризик виникнення раптових кровотеч. * Целіакія також пов'язана з синдромом підвищеного розмноження бактерій у тонкій кишці (Small bowel bacterial overgrowth syndrome), який може погіршити важкість мальабсорбції або бути причиною її виникнення, незважаючи на лікування. Різне
Целіакію пов’язують з низкою різних симптомів. У багатьох випадках дуже важко зрозуміти, чи захворювання спричинене дією клейковини чи цей розлад пов’язаний з іншими причинами.
Дефіцит імуноглобуліну А (ІgA) характерний для 2,3% пацієнтів з целіакією, проте разом з тим, це порушення збільшує ймовірність виникнення целіакії у 10 разів. Щодо інших особливостей то при цьому дефіциті суттєво підвищується ризик появи інфекцій та аутоімунних захворювань.
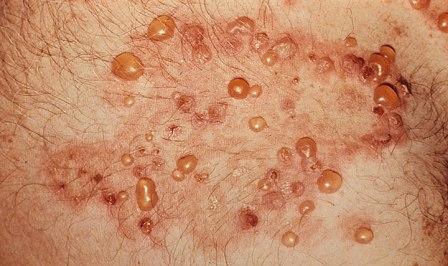
Герпетиформний дерматит – це розлад, який спричиняє свербіж шкіри пов'язаний з порушенням діюферменту трансглутамінази в шкірі. Зміни будови тонкої кишки при цьому ідентичні тим, які виникають при целіакії, і можуть бути викликані реакцією організму на клейковину, навіть якщо немає жодних шлунково-кишкових симптомів;
Затримка фізичного розвитку і (або) статевого дозрівання в підлітковому віці може відбуватися навіть без явних симптомів порушення діяльності кишечника або важких порушень процесів харчування. Для того, щоб оцінити відхилення у фізичному розвитку часто рекомендують провести скринінгове обстеження органів черевної порожнини.
Періодичні викидні і безпліддя (причина якого не виявлена); Гіпоспленізм (Hyposplenism) (розмір селезінки менший нормального значення) - це явище характерне приблизно для третини випадків захворювання на целіакію і може призводити до порушення функцій селезінки, які спрямовані на захист організму від дії бактерій.
Порушення печінкових проб (біохімічного аналізу крові), які можуть бути випадково виявлений при біохімічному аналізі крові;
Целіакія пов'язана з низкою інших захворювань, багато з яких є аутоімунними порушеннями. Цукровий діабет 1 типу, аутоімунний тиреоїдит, первинний біліарний цироз печінки і мікроскопічний коліт.
Іноді виявляють зв'язок целіакії з захворюваннями іншої групи (проте цей зв'язок на сьогодні залишається спірним питанням), для яких характерною рисою є наявність антитіл анти-гліадіну (виявлених за допомогою проведення старіших неспецифічних тестів), проте ці захворювання не пов’язані з тонким кишківником. Іноді, ці захворювання теж лікуються зменшенням рівня вживання клейковини. До цих розладів належить мозочкова атаксія, периферична нейропатія, шизофренія та аутизм.
Інші зернові
Деякі сорти пшениці та крупи з них (наприклад, такі як полба, манна крупа і тверді сорти пшениці), а також інші пов'язані з ними види, такі як ячмінь, жито, тритикале (нова озима або яра злакова рослина, штучно створена селекціонерами схрещуванням жита з пшеницею) та камут, також можуть викликати симптоми целіакії. Невелика частка хворих на целіакію реагують також на овес. Найбільш ймовірно, що овес викликає симптоми целіакії через перехресне запилення іншими зерновими на полях або в каналах розподілу. Тобто, овес не рекомендується вживати людям із цим захворюванням.
Інші зернові, такі як кукурудза, просо, сорго, теф, звичайний і дикий рис - безпечні для пацієнтів, так само як незлакові культури, такі як амарант, лобода або гречка. Незернові, багаті вуглеводами продукти, такі як картопля і банани не містять глютену і не викликають симптоми захворювання. Патофізіологія
Вважається, що целіакія є поліфакторіальною хворобою, оскільки її виникнення може спричинити більш ніж один генетичний фактор, а для проявлення її у пацієнта необхідною є наявність також більше ніж одного фактора. Майже усі вражені пацієнти мають HLA-DQ2 варіант алелі. Проте, близько 20-30% людей, які не мають целіакії успадкували HLA-DQ2 алель. Саме це передбачає необхідність додаткових чинників для розвитку хвороби. Крім того, близько 5% людей у яких розвивається хвороба не мають гена DQ2. HLA-DQ2 алель характеризується неповною пенетрантністю, адже пов’язані із хворобою алелі гена, з'являються у більшості пацієнтів, проте вони є присутніми не в усіх випадках, а самі по собі не є достатньою причиною виникнення захворювання. Генетика
Переважна більшість пацієнтів з целіакією мають один з двох типів HLA-DQ. Цей ген є частиною II класу антигенів- рецепторів головного комплексу гістосумісності (MHC class II antigen-presenting receptor), інша назва якого людський лейкоцитарний антиген. Гени цієї системи, відповідають за розрізнення власних і чужих клітин організмом, тобто пов’язані з імунною системою. Ген, порушення діяльності якого викликає целіакію, розташований на короткому плечі шостої хромосоми і має назву CELIAC1.
На сьогодні відомо сім варіантів HLA-DQ (DQ2 і DQ4-DQ9). Понад 95% хворих на целіакію мають спадкову ізоформу DQ2 або DQ8. Причина, чому ці гени, викликають підвищення ризику виникнення целіакії полягає в тому, що рецептори цих генів утворюють з пептидами гліадину більш сильний зв'язок , ніж інші антиген-презентуючі рецептори (antigen-presenting receptor). Тобто, ймовірно що саме ці форми рецептора, активують Т-лімфоцити і, відповідно, аутоімунний процес.
Більшість хворих на целіакію є носіями двох генів гаплотипу HLA- DQ2, які відносяться до гаплотипу DQ2.5. Цей гаплотип складається з двох суміжних алелей гена DQA1 * 0501 і DQB1 * 0201, які кодують дві субодиниці, DQ α5 і DQ β2. У більшості осіб, ця DQ2.5 ізоформа кодується однією з двох копій 6 хромосоми, успадкованих від батьків. Більшість осіб, хворих на целіакію успадковують тільки одну копію цього гаплотипу DQ2.5, а деякі успадковують його від обох батьків. В останніх, ризик виникнення целіакії особливо високий, крім того, вони більш схильні до появи різноманітних ускладнень.
Деякі люди успадковують DQ2.5 від одного з батьків і частину гаплотипу (DQB1 * 02 або DQA1 * 05) від іншого, таким чином, у таких осіб ризик розвитку захворювання теж збільшується. Рідше, люди успадковують DQA1 * 05 алель від одного з батьків і DQB1 * 02 від іншого, це явище називається транс-гаплотипною асоціацією, і ризик виникнення захворювання у цих людей аналогічний тим особам, які успадковують одну копію 6 хромосоми з DQ2.5 гаплотипом, але в цьому випадку, хвороба не вважається сімейною. Серед хворих жителів Європи 6% не мають DQ2.5 (цис-чи транс) або DQ8 (кодує гаплотип DQA1 * 03: DQB1 * 0302), 4% мають ізоформу DQ2.2, а у тих 2%, що залишилися відсутні DQ2 або DQ8.
Поширеність цих генів залежить від географічного положення. DQ2.5 дуже поширений серед народів Північної і Західної Європи (найчастіше серед басків та ірландців), частини населення Африки та Індії. Проте, ці гени взагалі не зустрічаються в країнах, які знаходяться у західній частині Тихого океану. DQ8 – більш поширений, ніж DQ2.5, і найчастіше зустрічається серед жителів Південної і Центральної Америки, близько 90% людей серед населення американських індіанців є носіями DQ8, тобто, можна говорити про наявність у них целіакічного фенотипу (celiac phenotype).
Про наявність інших генетичних факторів, які спричиняють целіакію досить часто повідомляють і сьогодні, проте частота їх появи теж залежить від географічного розташування. Тільки локуси HLA-DQ зустрічаються у більшості населення світу. Багато з локусів, як виявилося пов’язані з іншими аутоімунними захворюваннями. Один ген - LPP (lipoma-preferred partner gene) бере участь в адгезії позаклітинного матриксу на поверхні клітин, а дещо змінена його варіація (SNP = rs1464510) збільшує ризик розвитку захворювання приблизно на 30%. Цей ген, часто викликає целіакію (достовірність р <10-39) у населення Європи та США.
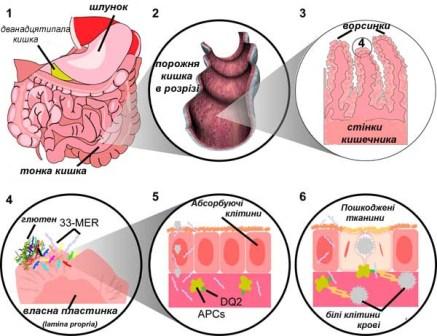 Проламіни
Більшість наявних в їжі білків, які відповідають за імунну реакцію при целіакії - це проламіни. Ці накопичувальні білки багаті проліном (прол-) і глютаміном (-аміни), вони розчиняються в спиртах і стійкі до протеаз і пептидаз кишечника. Проламіни знаходяться в зернових культурах, проте різні зерна мають різні, але пов'язані проламіни: пшениця (гліадин), ячмінь (гордеїн), жито (секалін), кукурудза (зейн), а також незначна кількість білка авеніну міститься у вівсі. Одна область α-гліадину стимулює клітини мембран ентероцитів кишечника, для того, щоб пропустити більші молекули між клітинами. Порушення щільних контактів двох клітин, мембрани яких об'єднані разом для формування практично непроникаючого для рідини бар'єру, дозволяє пептидам більшим за три амінокислоти потрапити в організм.
Мембранний витік пропускає пептиди гліадину, які стимулюють два рівні імунних реакцій, вроджені і адаптивні (опосередковані клітини Т-хелпери). Один пептид резистентний до дії протеаз з α-гліадину містить регіон, який стимулює лімфоцити і призводить до вивільнення інтерлейкіну 15 (ІЛ-15). Ця вроджена відповідь на гліадин має результатом реакцію імунної системи, яка активує запальні клітини і збільшує випуск запальних хімічних речовин. Найсильніша і найбільш поширена реакція на гліадин спрямована на фрагмент α2-гліадину, який складається з 33-ох амінокислот. Ця реакція відбувається у більшості уражених целіакією осіб, які мають DQ2 ізоформу. Цей пептид, змінений кишковою трансглутаміназою, має високу щільність перекриття епітопів Т-клітин. Це збільшує ймовірність того, що при розпізнаванні Т-клітинами DQ2 ізоформа буде зв'язуватися й надалі бути пов'язаною з пептидом.
Гліадин у пшениці є найкраще вивченим і найбільш зрозумілим членом цієї сім'ї, проте існують й інші проламіни, які можуть сприяти появі целіакії, а саме гордеїн (з ячменю) і секалін (з жита). Однак, не всі проламіни викликають цю імунну реакцію і досі триває суперечка про здатність авеніну (проламін, який знаходиться в вівсі) викликати реакцію при целіакії. Тканинна трансглутаміназа
У більшості випадків захворювання на целіакію в організмі хворих знаходять анти-антитіла до тканинної трансглутамінази (ТТГ). Тканинна трансглутаміназа змінює пептиди клейковини на форму яка викликає більш ефективну імунну реакцію.
Ці пептиди можуть змінюватися під дією ТТГ двома способами: дезамідування або переамідування.
Дезамідування - це реакція, у процесі якої, при розщепленні іпсилон аміногрупи бічного ланцюга глютаміну утворюється залишок глутамату. Переамідування, зустрічається втричі частіше ніж дезамідування. При переамідуванні відбувається об’єднання (утворення крос-зв’язків) залишків глутаміну (з пептиду гліадину) з залишками лізину тканинної трансглутамінази у процесі реакції, яка каталіується трансглутаміназою. Об’єднання може відбуватися або всередині або поза активним центром ферменту. В останньому випадку утворюється стійкий ковалентно зв’язаний комплекс гліадину і ТТГ. Це призводить до утворення нових епітопів які, як вважають, викликають первинну імунну відповідь, внаслідок якої утворюються аутоантитіла проти ТТГ. Результати біопсії пацієнтів, у яких підозрювали целіакію, показують, що наявність аутоантитіл (навіть якщо особа ще не мала симптомів захворювання) в більшості випадків мала наслідком розвиток хвороби в майбутньому. Аутоантитіла знаходять також у пацієнтів, які страждають від інших аутоімунних захворювань, анемії або явищ мальабсорбції, набагато частіше ніж у здорового населення.
Ендомізіальні компоненти антитіл (EMA) до ТТГ, як вважають, спрямовані проти поверхневої трансглутамінази. Наявність цих антитіл і на сьогодні використовується для підтвердження або спростування діагнозу целіакії. Проте, у 2006 році було проведено дослідження, яке показало, що ЕМА-негативні пацієнти, хворі на целіакію, як правило, є чоловіками старшого віку, які мають більш важкі черевні прояви і нижчий ризик виникнення «нетипових» симптомів, включаючи аутоімунні захворювання. При цьому дослідженні кількість анти-ТТГ антитіл не корелює з важкістю проявів у результаті пошкодження ворсинок. Ці дані в поєднанні з проведеним нещодавно дослідженням показують, що гліадин має власний компонент, який провокує хвороботворну реакцію. Дослідники припускають, що саме гліадин може бути більшою мірою відповідальним за первинні прояви целіакії, тоді як ТТГ відіграє більш важливу роль при появі вторинних ефектів, таких як алергічні реакції і вторинні аутоімунні захворювання. У великої частки хворих на целіакію, анти-ТТГ антитіла також розпізнають ротавірусний білок VP7. Ці антитіла стимулюють проліферацію моноцитів, саме тому ротавірусна інфекція може пояснити початкову причину процесу проліферації імунних клітин. Дійсно, на початковому етапі, ротавірусне пошкодження кишечника призводить до атрофії ворсинок. Це говорить про те, що вірусні білки можуть провокувати активацію кросреакції організму, під час якої виробляються анти-VP7. Антитіла до VP7 можуть також сповільнювати загоєння в той час як гліадин-опосередкована презентація ТТГ забезпечує друге джерело утворення крос-реактивних (перехресних) антитіл.
Атрофія ворсинок і мальабсорбція
Запальний процес, спричинений Т-клітинами, призводить до порушення структури і функцій слизової оболонки тонкої кишки і спричиняє мальабсорбцію, що знижує здатність організму засвоювати поживні речовини, мінерали та жиророзчинні вітаміни А, D, E та K, які надходять з їжею. Можливою є непереносимість лактози через зниження ворсинок з поверхні кишечника і скорочення виробництва лактази, але зазвичай цю проблему можна вирішити при лікуванні хвороби.
Були запропоновані альтернативні причини цього пошкодження тканин, вони включають в себе: звільнення інтерлейкіну 15 і активацію імунної системи пептидом короткої клейковини (p31-43/49). Це викликає «знищення» ентероцитів лімфоцитами в епітелії. Атрофія ворсинок, яку можна побачити при біопсії може виникати через непов'язані із хворобою причини, такі як тропічну спру (тропічна діарея), лямбліоз та радіаційний ентерит. Хоча позитивна серологія та типова біопсія є певними вказівниками наявності целіакії, відсутність реакції на дієту може бути основою для визнання цього альтернативного діагнозу.
Модифікатори ризику
Є багато різних теорій щодо того, що визначає, чи буде у генетично вразливої людини розвиватись целіакія. Основні теорії виникнення хвороби включають інфекції ротавірусу або аденовірусу кишечника людини. Деякі дослідження показують, що куріння захищає від появи целіакії у дорослому віці. Перспективне і обсерваційне дослідження 2005 року показало, що затрати часу дії на клейковину в дитинстві є важливим модифікатором ризику. Люди, що споживали пшеницю, ячмінь або жито в період до повноцінного формування захисного бар'єру кишки (протягом перших трьох місяців після народження) мають у п'ять разів вищий ризик розвитку целіакії ніж ті, хто споживає їх після чотирьох-шести місяців після народження.
Крім того, було виявлено що ризик захворюваності у тих то приймав пізніше ніж через шість місяців після народження був тільки злегка підвищений у порівнянні з попередньою групою. Дослідження, проведене в 2006 році показало, що раннє введення злаків у раціон захищає від появи алергії на них. Грудне вигодовування також може зменшити ризик виникнення хвороби. Аналіз показав, що продовження грудного вигодовування до введення в дієту зернових, які містять клейковину було пов'язане з 52% зниженням ризику розвитку целіакії у дітей грудного віку, проте залишається не відомим чи це співвідношення зберігається в дорослому віці. Діагностика
На сьогодні відомо кілька тестів, які дають змогу точно діагностувати наявність целіакії. Порядок використання тестів встановлюється на основі рівня прояву симптомів. Проте, всі випробування втрачають свою корисність, якщо пацієнт вже дотримується безглютенової дієти. Діяльність кишківника починає покращуватися, через декілька тижнів після вилучення клейковини з раціону, а зниження рівня антитіл відбувається протягом декількох місяців. Для осіб, які вже почали дотримуватися безглютенової дієті, необхідним може бути повторний виклик симптомів (реакції організму) з допомогою вживання продуктів, які містять клейковину. Це повинен бути один прийом їжі в день, на протязі 2-6 тижнів. Тільки після цього, можна здійснювати повторні дослідження.
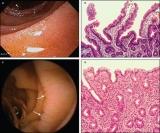 Формуючи діагностичну систему, шляхом комбінації тих результатів, які можливо отримати під час використання ендоскопічної біопсії (на рис. розміщеному зліва два верхніх зображення - результати досліджень характерні для здорової людини, а два нижніх, для людини хворої на целіакію), дослідники повідомили про 100% чутливість (при ідентифікації всіх випадків) серед пацієнтів з високим індексом підозри на целіакію, з супутньою специфічністю 61% (частка хибно-позитивних результатів 39%). Формуючи діагностичну систему, шляхом комбінації тих результатів, які можливо отримати під час використання ендоскопічної біопсії (на рис. розміщеному зліва два верхніх зображення - результати досліджень характерні для здорової людини, а два нижніх, для людини хворої на целіакію), дослідники повідомили про 100% чутливість (при ідентифікації всіх випадків) серед пацієнтів з високим індексом підозри на целіакію, з супутньою специфічністю 61% (частка хибно-позитивних результатів 39%). Лікарі рекомендують, що під час діагностики, пацієнти з симптомами, які вказують на високий ризик присутності захворювання, або ж ті, які мають позитивний аналіз крові, повинні пройти ендоскопічну біопсію другої частини дванадцятипалої кишки. Дослідження визначає такі симптоми (які вказують на високий ризик розвитку захворювання) як: втрата ваги, анемія (гемоглобін менше 120 г/л у жінок або менше 130 г/л у чоловіків) або діарея (більше трьох рідких випорожнень у день).
Аналізи крові
Серологічні аналізи крові є першочерговим методом дослідження необхідним для діагностики целіакії. Антиендомізіальні антитіла IgA можуть вказати на наявність целіакії з чутливістю і специфічністю 90% і 99% відповідно. Систематичний огляд вказує на те, що поширеність целіакії при первинній допомозі пацієнтам з шлунково-кишковими симптомами складає близько 3%.
Спочатку зазначалось, що серологія антитіл трансглутамінази (anti-tTG) має високу чутливість (99%) і специфічність (> 90% ) виявлення целіакії, проте при систематичному огляді було встановлено, що ці два тести були схожими. Сучасні анти- tTG аналізи покладаються на людський рекомбінантний білок в якості антигену. Першочергово необхідно зробити перевірку tTG, як найпростіший вид дослідження. Результати, що викликають сумнів повинні супроводжуватися аналізом антитіл до ендомізіуму.
При позитивному аналізі крові лікарі рекомендують пацієнтам зробити ендоскопію / гастроскопію та біопсію. Негативний результат серології може також супроводжуватись рекомендаціями для проходження ендоскопії та біопсії дванадцятипалої кишки, якщо клінічні підозри залишаються високими через 1 зі 100 "помилково-негативних" результатів. Таким чином, біопсія тканини як і раніше вважається «золотим стандартом» при діагностиці целіакії.
Історично аналізується наявність трьох інших антитіл: анти-ретикуліну (АRА), анти-гліадину (АGА) і анти-ендомізіуму (EMA). Аналіз крові може бути ненадійним джерелом при діагностиці у маленьких дітей. Дослідження анти-гліадину (виконується більш належним чином) використовується частіше у дітей до п'ятирічного віку. Серологічні тести засновані на реакції імунної флюоресценції - РІФ (ретикулін, гліадин і ендомізіум) або імуноферментному аналізі -ІФА (гліадин або тканина трансглутаміназа, tTG).
Спеціалісти рекомендують паралельно перевіряти загальний рівень IgA в сиворотці крові, оскільки пацієнти з дефіцитом IgA можуть бути не в змозі виробляти антитіла, на основі яких базуються ці випробування("хибно-негативні"). У тих пацієнтів, антитіла IgG проти трансглутамінази (IgG-TTG) можуть бути діагностичними.
Аналіз на наявність антитіл і людського лейкоцитарного антигену (ЛЛА, англ. HLA) мають аналогічну точність. Тим не менше, в даний час не рекомендується широко застосовувати аналіз HLA для виключення наявності целіакії.
Ендоскопія
Для діагностики проводиться верхня ендоскопія з біопсією дванадцятипалої кишки (вище цибулини дванадцятипалої кишки) або тонкої кишки. Для лікаря дуже важливо отримати декілька зразків з дванадцятипалої кишки (від 4 до 8). Не всі ділянки можуть бути пошкоджені, тому якщо під час біопсії буде взято зразок здорової тканини, то результат буде хибним.
У більшості пацієнтів, які уражені целіакією при ендоскопії тонка кишка здається нормальною, однак присутність одночасно п'яти ендоскопічних відхилень можуть вказати на наявність целіакії: східчата(scalloping) тонка кишка, мала кількість складок, мозаїчна слизова оболонка (вигляд якої нагадує засушене, потріскане болото), порушення підслизової основи, яка вкриває кров’яні судини і нерівність слизової оболонки.
До 1970-х років, біопсія проводилася шляхом використанням металевих капсул, які були обладнані спеціальним всмоктувальним пристроєм. Ця капсула ковталася і проходила в тонкий кишківник. Після рентгенівської перевірки її розташування, активовувався всмоктувальний механізм, який давав змогу отримати зразок тканини кишкової стінки, який поміщався в капсулу.
На практиці часто використовували такі капсульні системи, як капсула Ватсона та Кросбі-Куглера. Проте, сьогодні цей метод вже майже повністю замінений оптико - волоконною ендоскопією, чутливість і точність якої значно вища.
Патологія
Зазвичай патологічні зміни, характерні для целіакії тонкої кишки класифікуються згідно з "КласифікацієюМарша":
- 0 стадія - нормальна слизова оболонка;
- 1 стадія - збільшення числа внутрішніх епітеліальних лімфоцитів. Їх кількість, як правило, перевищує 20 лімфоцитів на 100 ентероцитів;
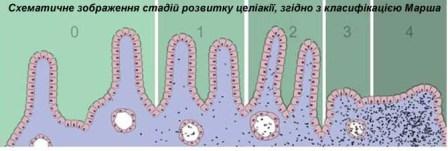 - 2 стадія - проліферація Ліберкунових крипт (crypts of Lieberkuhn)- трубчастих заглиблень епітелію слизової оболонки кишківника;
- 3 стадія - часткова або повна атрофія ворсинок;
- 4 стадія - гіпоплазія малої архітектури кишечника.
М. Марш запропонував таку класифікацію у 1992 році, згодом, у 1999 році, кількість стадій була збільшена до шести. Це було здійснено через поділ третьої стадії на три підстадії (рис. зліва). Проте, подальші дослідження показали, що ця система не завжди надійна і що зміни, які спостерігаються при целіакії можуть бути описані в одному з трьох етапів - A. Стан здоров’я хворих на целіакію, як вже було сказано суттєво покращується після виведення з раціону клейковини. Однак, більшість спеціалістів не радять здійснювати повторну біопсію до того часу поки не буде покращення стану здоров’я після зміни раціону.
Більш детальну інформацію про це захворювання ви зможете знайти у статті: "Целіакія (частина друга)" <<<
Алькаптонурія
Гістидинемія
Гомоцистинурія
Полікістозна хвороба нирок
Хвороба Вільсона – Коновалова
Cиндром Марфана (Хвороба Марфана)
X-зчеплений іхтіоз
Анемія Фанконі
Аргініносукцинатна ацидурія
Бета-таласемія
Бічний аміотрофічний склероз (частина друга)
Бічний аміотрофічний склероз (частина перша)
Галактоземія
Гемоглобін Е
Гемоглобін С
Гемохроматоз
Глікогенози
Дальтонізм (частина друга)
Дальтонізм (частина перша)
Дефіцит 3-гідкрокси-метил-глутарил КоА ліази
Дефіцит 3-метилкротоніл-коензим А карбоксилази
Дефіцит альфа 1 антитриптисину
Дефіцит бета-кетотіолази
Дефіцит біотинідази
Дефіцит дигідропіримідин дегідрогенази
Дефіцит довголанцюгової ацил-коензим А дегідрогенази
Дефіцит коротколанцюгової ацил-коензим А дегідрогенази
Дефіцит метилентетрагідрофолат редуктази
Дефіцит прекалікреїну
Дефіцит синтетази голокарбоксилази
Дефіцит фактора ХІ
Ентеропатичний акродерматит
Іміногліцинурія
М'язова дистрофія Дюшена
Муковісцидоз
Нейрофіброматоз
Органічні ацидемії
Первинний системний дефіцит карнітину
Перманентний неонатальний цукровий діабет
Перонеальна дистрофія Шарко-Марі -Тута (частина друга)
Перонеальна дистрофія Шарко-Марі-Тута (частина перша)
Пропіонова ацидурія
Псевдополідистрофія Гурлера
Серповидно-клітинна анемія (частина друга)
Серповидно-клітинна анемія (частина перша)
Синдром Ангельмана
Синдром Бартера
Синдром Блума
Синдром Дабіна Джонсона
Синдром Дауна (частина друга)
Синдром Дауна (частина перша)
Синдром Едвардса
Синдром Клайнфельтера-Рейфенштейна-Олбрайта
Синдром котячого крику (5р)
Синдром Кріглера Найара
Синдром Леша-Наяна
Синдром Лойса-Дітца
Синдром Патау
Синдром Прадера-Віллі
Сімейна вегетативна дисфункція
Сімейна гіперхолестеринемія
Тирозинемія
Тирозинемія І типу
Тирозинемія ІI типу
Тирозинемія ІIІ типу
Фенілкетонурія (ФКУ)
Фруктоземія
Хвороба I клітин
Хвороба Гірке
Хвороба Дауна
Хвороба Канавана
Хвороба кленового сиропу
Хвороба Краббе
Хвороба Німана – Піка
Хвороба Тея-Сакса (друга частина)
Хвороба Тея-Сакса (перша частина)
Хвороба Фабрі
Хвороба фон Віллебранда
Хвороба Хантінгтона
Целіакія (частина друга)
Целіакія (частина перша)
Церебротендінальний ксантоматоз
|