ПублікаціїРозриви і розшарування стінки аорти у хворих на синдром Марфана Львівський національний медичний університет імені Данила Галицького
Ключові слова: синдром Марфана, розриви і розшарування стінки аорти, етіологія, патофізіологія, клініка, діагностика, лікування
Резюме. У статті представлені сучасні погляди на проблему розривів і розшарування стінки аорти у хворих на синдром Марфана. Описана роль еластичних волокон і трансформуючого фактору росту β у виникненні розшарування стінки аорти, значення відображення пульсової хвилі в аорті. Наведено статистичну інформацію ураження різних відділів аорти у хворих на синдром Марфана. Подані сучасні рекомендації з медикаментозного та хірургічного лікування розшарування і розривів аорти.
Розриви та розшарування стінки аорти залишаються актуальною проблемою. Вони є основною і найчастішою причиною смерті у хворих на синдром Марфана (СМ) .
Прогресуюча ектазія висхідної аорти у хворих на СМ, що призводить до формування аневризми аорти, фатального розриву аорти або розшарування її стінки. Рання діагностика та своєчасне лікування судинних ускладнень у цих хворих є надзвичайно важливим і значно покращує тривалість життя (Pratt B., Curci J., 2010).
Синдром Марфана – це генетичне захворювання, успадковане за автосомно-домінантним типом з характерним ураженням серцево-судинної системи, скелету та очей. В основі СМ є дефект гена фібриліну-1 (fibrillin 1, FBN1), який кодує білок позаклітинного матриксу, що входить до складу еластичних волокон.
Недостатність FBN1 у мишей є загальноприйнятою моделлю СМ, що повторює серцево-судинний фенотип, показує дегенеративні зміни в середньому шарі стінки аорти, іноді з виникненням запальних інфільтратів, розширення або розшарування її. Другий ген СМ визначений недавно як трансформуючий фактор росту β (TGF-β) (Ali R Keramati, 2010; Yu Wang, 2010). 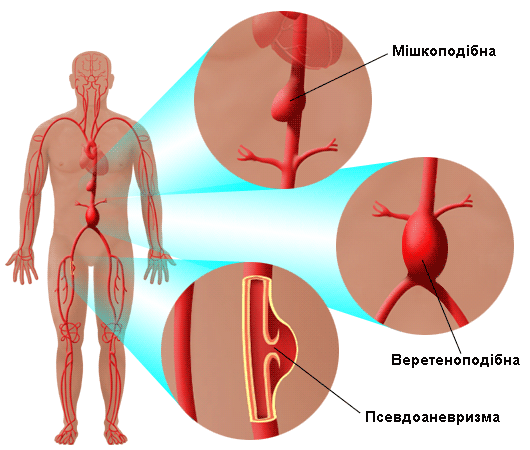 Еластичні волокна – один з найважливіших елементів стінки аорти. Механічна або функціональна недостатність еластину в стінці аорти сприяє формуванню аневризми і розшаруванню стінки. Еластичні волокна – один з найважливіших елементів стінки аорти. Механічна або функціональна недостатність еластину в стінці аорти сприяє формуванню аневризми і розшаруванню стінки. Роль патології еластину і еластичних волокон в розшаруванні аорти (РА) має важливе значення, особливо у пацієнтів з СМ. Доведено, що підвищення рівня (TGF-β) сприяє схильності стінки аорти до розшарування (на рисунку зліва зображено основні типи аневризм). Препарати, які пригнічують TGF-β можуть бути корисним у скороченні ризику РА у пацієнтів з СМ (Pratt B., Curci J., 2010). Захворювання, асоційовані з аневризмою грудного відділу аорти і розшаруванням стінки називали кістозним медіа некрозом, але цей термін є неточним, оскільки хвороба не є пов'язана з некрозом аорти або формуванням кіст.
Точніший термін «медіа дегенерація» характеризується тріадою змін: - втратою гладком’язових клітин (як правило ділянки, а не повна втрата), - фрагментацією або втратою еластичних волокон - збільшенням протеогліканів. Хоча термін «медіа дегенерація» був описаний як незапальне захворювання, сучасні дослідники вказують на наявність запальної інфільтрації клітин (ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/ SVM Guidelines, 2010). Встановлено, що запалення в стінці аорти відіграє важливу роль у прогресуванні розшарування аорти у хворих на СМ. У хворих знаходять Т-лімфоцити, В-лімфоцити та макрофаги у медії і адвентиції аорти (особливо навколо vasa vasorum). Існує подібність запальних змін у стінці аорти при СМ і гігантоклітинному артеріїті та артеріїті Такаясу. Патогістолоічні дослідження показують, що Т-лімфоцити проникають у стінку аорти через активацію ендотеліальних клітин у vasa vasorum, а не через ендотелій інтими аорти. Встановлено, що імунний медіа аортит може брати участь у патогенезі аневризми висхідного відділу аорти у хворих на СМ, що пов’язано з запальним інфільтратом у середньому шарі аорти (Rumin He. et al., 2008).
У хворих на СМ з аневризмою аорти спостерігаються локальні або глобальні відображення пульсової хвилі в аорті. Для їх виміру використовують ехокардіографію і магнітно-резонансну томографію з контрастуванням, щоб визначити центральний тиск, тип течії хвилі, локальний і глобальний коефіцієнти відображення. Раннє повернення відображених хвиль підвищує систолічний тиск і створює додаткове навантаження на серце і великі судини.
Ці хвилі відображення розглядають як один з важливих факторів, що визначають центральний артеріальний тиск і можуть сприяти розвитку дилатації аорти і її розриву. Збільшення довжини аорти, з одного боку і збільшення жорсткості стінки аорти з іншого сприяють посиленню хвиль відображення. Досліджено зв'язок між важкістю серцево-судинного фенотипу у хворих на СМ і типом FBN1 мутації. Також існує кореляція між показниками жорсткості стінки аорти і типом FBN1 мутації, але FBN1 генотип не єдиним фактором, що визначає жорсткість стінки аорти (De Backer J., 2009; Segers P., et al., 2006). Ураження аорти при СМ реєструють у 65–100 % випадків. В значній кількості випадків (6–9 %) РА, зустрічається у молодому віці з локалізацією розшарування в проксимальному відділі аорти. Спадковий дефект сполучної тканини призводить до ураження серцево-судинної системи, а саме:
- дилатації синусів Вальсальви, - аортальної регургітації, - аневризми аорти, - пролапсу мітрального клапана (Siepe M., 2009). Найчастіше розширюється ділянка синуса Вальсальви (56,9%) або висхідної частини аорти (63,6 %), причому навіть значна дилатація перебігає безсимптомно. Іноді відзначають біль за грудниною при фізичному навантаженні, пов’язаний з рефлексом із перерозтягнутої аортальної стінки. Достовірна діагностика дилатації синуса Вальсальви можлива при проведенні ехокардіографії.
Рентгенологічне дослідження малоінформативне через деформацію грудної клітки, що приводить до зміни позиції аорти і тіні серця щодо хребта. За даними Осовської Н.Ю. (2009) у молодих пацієнтів (15–25 років) із СМ ширина кільця аорти була достовірно більшою, ніж у групі контролю, а також втричі частіше спостерігалася аневризма синусів Вальсальви. Аневризма синуса Вальсальви до прориву не викликає гемодинамічних порушень і зазвичай є випадковою знахідкою при ехокардіографічному дослідженні. Некоронарний синус ушкоджується в 26% і зазвичай проривається в праве передсердя. Лівий коронарний синус ушкоджується в 5% випадків. Ехокардіографія дозволяє візуалізувати вибухання одного або декількох синусів у парастернальній проекції по короткій вісі на рівні аортального клапана та турбулентний потік крові в тій камері, в яку відбувся прорив аневризми (Martin G., 2008; Осовська Н. Ю. 2008; Siepe M., 2009). Разом з аневризмою синуса Вальсальви при синдромі Марфана можуть спостерігатися аневризми висхідної частини аорти, дуги, рідше – низхідної частини аорти і черевного відділу аорти. Ураження саме аорти при синдромі Марфана визначає прогноз і тяжкість захворювання в основної частини хворих. Серед дорослих пацієнтів прогноз для життя є несприятливим.
Смерть настає у половини хворих з СМ серед осіб чоловічої статі до 40-річного віку, а серед жінок – до 50-річного. Критичні періоди життя, в які існує високий ризик розриву аневризми – це вік від 15 до 18 років і від 40 до 45 років. Близько половини РА зустрічається у вагітних віком більше 40 років: частіше – в третьому триместрі; рідко – в ранній післяпологовий період. Причини розвитку РА у цієї категорії хворих до кінця не з’ясовані, значення надають збільшенню об’єму крові, серцевого викиду і підвищенню артеріального тиску. Особливо високий ризик РА у жінок із СМ під час вагітності. Іноді діагноз СМ встановлюється після діагностики РА у післяпологовому періоді (Осовська Н. Ю. 2009; Зильбер А.П., 1999). Класичні рекомендації з лікування СМ передбачають:
- зміни способу життя, включаючи помірні обмеження фізичної активності; - профілактика ендокардиту; - регулярна візуалізація аорти; - прийом медикаментів; - профілактична заміна висхідної аорти. Сьогодні немає великих, рандомізованих контрольованих клінічних досліджень щодо використання медикаментозної терапії у хворих на СМ. Незважаючи на це, використовують чотири групи препаратів, щоб затримати або профілактувати РА: - β-блокатори, антагоністи кальцію, - інгібітори ангіотензин-перетворюючого ферменту, - блокатори рецепторів ангіотензину ІІ (Stuart Alan Graham, 2007). Результати клінічних спостережень вказують на те, що раннє хірургічне втручання на аорті у випадку РА значно продовжує життя хворим і профілактує ускладнення. У табл. 1 наводимо Європейські рекомендації щодо показів до оперативного лікування хворих на РА.
Таблиця 1 Вимоги до оперативного втручання з приводу РА у хворих на СМ, ESC Guidelines 2010
Популяційні зміни аортального клапана і висхідного відділу аорти є сталими з низьким ризиком і тривалою роботою після оперативного втручання (оперативна смертність 1,5% на планові операції та 11,7% – на ургентні). П'яти і десятирічне виживання складає 84% і 75% відповідно. При синдромі Марфана ризик повторного розшарування та рецидивуючих аневризм значно вищий, ніж у разі хвороб аорти іншої етіології. У пацієнтів з анатомічно нормальними клапанами, в яких недостатність пов'язана з розширенням кільця або розшаруванням, клапан-зберігаючі операції з заміною кореня аорти на протез Dacron з реімплантацією коронарних артерій у протез (методика David’s) або реконструкції кореня аорти (методика Yacoub’s) тепер стали кращими хірургічними процедурами. Аортальна регургітація є найчастішим ускладненням, яка вимагає повторної операції у 20% пацієнтів після десяти років. Довгострокових результатів клапан-зберігаючих операцій із заміни кореня аорти при синдромі Марфана все ще невідомо. Основним оперативним втручанням, яке застосовується сьогодні є операція вперше описана у 1968 році двома хірургами Hugh Bentall і A. De Bono (заміна аортального клапана, синуса аорти і висхідної аорти). Штучні клапани серця можуть зношуватися або вимагають антикоагулянтів. Часто у хворих з СМ виявляють нормальний аортальний клапан, що є показом до клапанозберігаючих операцій. Є декілька повідомлень про короткостроковий успіх після ендоваскулярного стентування грудної частини низхідної аорти. Встановлення стента у хворих на синдром Марфана не рекомендується оскільки ризик звичайного відкритого хірургічного втручання є мінімальним (ESC Guidelines, 2010).
Таким чином, розриви і розшарування стінки аорти у хворих на СМ залишаються актуальною проблемою сучасної кардіології та кардіохірургії. Пошук нових методів діагностики та лікування є основним завданням, яке буде сприяти кращому розумінню механізмів виникнення розривів і розшарувань та дасть можливість лікарям проводити профілактику цих станів у хворих на СМ.
Література
Автор: Жураєв Р.К. <<< |
|||||||||||||||||||||||||||||||||